炔烃
结构

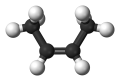
乙炔的分子模型
炔键(碳-碳三键)里的碳原子采取sp杂化:每个碳原子拥有2个p轨道和2个sp杂化轨道。两个来自不同碳原子的sp轨道重叠形成一个 sp-spσ键。一个原子的两个p轨道分别于另外一个原子的两个p轨道重叠,形成两个π键,这样一共就有3个键。剩下每一个原子的sp轨道可以与其他原子形成σ键,例如,都与氢原子结合就形成了乙炔。两个sp轨道分别在原子的两侧,互相对称:在乙炔中,H-C-C 的键角是180°。因为共有六个电子参与成键,所以三键的键能很高,有837千焦/摩。其中σ键贡献369千焦/摩,第一个π键贡献268千焦/摩,第二个π键稍弱,只有202千焦/摩。三键中两个碳的距离仅121皮米,对比烯烃为134皮米,烷烃有153皮米。
化学性质
与烷烃不同,炔烃不稳定并且非常活跃。因此乙炔燃烧发出大量的热,乙炔焰常被用来焊接。
例子
最简单的炔烃是乙炔。
末端炔烃和内部炔烃
末端炔烃至少有一个氢原子连接在经过sp杂化的碳上(即连接在三键碳上,一个例子就是丙炔)。
非末端炔烃中,是除了氢以外的其它原子或官能团连接在经过sp杂化的碳上,通常是另外一个碳原子,但也可能是一个杂原子。一个很好的例子是戊-2-炔,其中一个甲基连接在三键一端,三键另外一端则是连接的一个乙基。
末端炔烃可以和银氨络合物或者(亚)铜氨络合物反应生成白色的端炔银和暗红色的端炔铜(1价),这两者都不溶于水。此反应可以用于鉴定末端炔烃。
金属炔化合物
一个末端炔烃和一个强碱(例如:钠,氨基钠,正丁基锂或格林尼亚试剂)反应,生成末端炔烃的阴离子(一个 金属炔化合物 )。乙炔呈酸性。pK a为25,介于氨(35)和乙醇(16)之间。有这样的酸性和电子所在的sp杂化轨道中s所占的比重较大有关,在s轨道中的电子更倾向于靠近带正电的原子核因此能量较低,故带负电的炔阴离子比较稳定。
合成
炔烃的一般制备是通过邻二卤化烷烃的脱卤化氢作用,也可以通过金属炔化合物与一级卤化烷反应制得。在Fritsch-Buttenberg-Wiechell重排反应中,炔烃又溴化乙烯基起始制得。
炔烃也可以由醛通过Corey-Fuchs反应制得,亦可以通过Seyferth-Gilbert同素化制得。
乙炔的制备
乙炔可由碳化钙和水反应制备:先将碳酸钙加热产生氧化钙和二氧化碳,再将氧化钙和碳加热至摄氏3000度,产生碳化钙(电石)和一氧化碳,最后将碳化钙加水混和便产生乙炔和氢氧化钙。
反应
炔烃能参与很多的有机反应。
亲电加成反应
环加成
金属炔化合物的亲核取代反应
金属炔化合物的亲核加成反应
硼氢化氧化反应,炔烃和有机硼化合物生成乙烯基硼烷
被高锰酸钾氧化分解,生成羰基酸
由强碱导致的炔键在长链上的移动
炔烃的命名
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
关于我们

APP下载


























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}