细胞骨架
真核细胞骨架
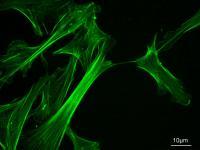
小鼠胚胎成纤维细胞的肌动蛋白细胞骨架,沾有phalloidin
微管
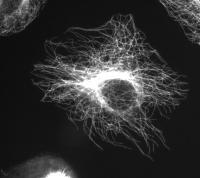
凝胶固着细胞的微管
微管 可在所有哺乳类动物细胞中存在,除了红细胞(红血球)外,所有微管均由约55kDa的α及β微管蛋白组成。它们正常时以异二聚体形式存在。并以头尾相连的方式聚合,形成微管蛋白原纤维(protofilament),一般由13根这样的原纤维构成一个中空的微管,直径22~25nm。少数变异的微管如线虫等所有的则有其他数目的原纤维。微管确定膜性细胞器(membrane-enclosed organelle)的位置和作为膜泡运输的导轨。微管是细胞骨架的架构主干,并也是某些胞器的主体,例如中心粒就是由9组3联微管组成的构造,而真核生物的纤毛与鞭毛也是由以微管为9+2结构,即由9个二联微管和一对中央微管构成,其中二联微管由AB两个管组成,A管由13条原纤维组成,B管由10条原纤维组成,两者共用5条。A管对着相邻的B管伸出两条动力蛋白臂,并向鞭毛中央发出一条辐。基体的微管组成为9+0,并且二联微管为三联微管所取代,结构类似于中心粒。组成的轴丝(axoneme)为主体。
从各种组织中提纯微管蛋白可以发现还存在一些其他蛋白成分(5%-20%),称之谓 微管相关蛋白 ( 英语 : microtubule-associated proteins ) 。这些蛋白具有组织特异性,表现出从相同αβ二聚体聚合形成的微管具有独特的性质,已从人类不同组织中发现了多种α及β微管蛋白,并追踪微管基因表现出部分基因家族,某些基因被认为是编码独特的微管蛋白。
微管形成的有些结构是比较稳定的,是由于微管结合蛋白的作用和酶修饰的原因。如神经细胞轴突、纤毛和鞭毛中的微管纤维。大多数微管纤维处于动态的聚合和灾变(一种突然的,迅速的,一般不可逆转的分解)状态,这是实现其功能所必需的性质(如纺锤体)。与秋水仙素结合的微管蛋白可加合到微管上,并阻止其他微管蛋白单体继续添加,进而破坏纺锤体的结构,长春花碱具有类似的功能。紫杉酚(taxol),能促进微管的聚合,并使已形成的微管稳定,然而这种稳定性会破坏微管的正常功能。这些药物可以利用破坏微管功能以阻止细胞分裂,成为癌症治疗的新希望。重水亦有阻止微管解聚而破坏微管功能之作用,但其机理在于完全排除了所需的微量普通水。这需要连续几天摄入完全是重水的水,因而实用价值不大。重水本身对细胞并无毒害。
在人类至少发现两种明显区别的α-微管蛋白及三种明显区别的β-微管基因,它们产生具有特定功能的微管蛋白mRNA,由于这些编码在结构组分上十分近似蛋白质分子,在不同组织存在多少特异性的具有差异表达的微管蛋白亚型,尚待深入研究。
除了α-与β-微管蛋白有编码相似的不同变异型,近几年来又发现了多种编码差异更大的新的微管蛋白,形成不同的基因家族。其中γ微管蛋白位于细胞内的微管组织中心(microtubule organizing center, MTOC),是用以提供α及β微管蛋白进行聚合反应形成微管的起始核心。而δ与ε则被认为与中心粒的结构与形成有关。其他尚有η, ζ, θ等等多种变异,不过通常仅存在少数几种真核单细胞生物如原虫或纤毛虫里,可能跟这些生物独特的结构与生理习性有关,进一步详情仍待研究。
微丝
微丝也普遍存在于所有真核细胞中,是一个实心状的纤维,一般细胞中含量约占细胞内总蛋白质的1%-2%,但在活动较强的细胞中可占20%-30%。在一般细胞主要分布于细胞的表面,直接影响细胞的形状。微丝具有多种功能,在不同细胞的表现不同,在肌细胞组成粗肌丝、细肌丝,可以收缩(收缩蛋白),在非肌细胞中主要起支撑作用、非肌性运动和信息传导作用。
微丝主要由肌动蛋白构成,和一种分子马达蛋白肌球蛋白一起作用,使细胞运动。它们参与细胞的变形虫运动、植物细胞的细胞质流动与肌肉细胞的收缩:
植物细胞的细胞质流动
微丝中的肌动蛋白与肌球蛋白在细胞质形成三维的网络体系。肌动蛋白位于外质,肌球蛋白位于内质。肌球蛋白连结著细胞质颗粒,由ATP供给能量,肌球蛋白与细胞质颗粒的结合体沿着actin filament滑动,从而带动整个细胞质的环流。
变形虫运动
变形虫运动 ( 英语 : Amoeboid movement ) (阿米巴运动)是肌肉细胞的收缩。如同微管蛋白,肌动蛋白的基因组成一个超家族,并组成多种极为相似的结构。例如,各种肌肉细胞有不同的肌动蛋白:
骨骼肌的条纹纤维;
心肌的条纹纤维;
血管壁的平滑肌;
胃肠道壁的平滑肌。它们在氨基酸组分上有微小的差异(大约在400个氨基酸残基序列中有4-6个变异),在肌肉与非肌细胞中都还存在β及γ肌动蛋白,它们与具有横纹的α肌动蛋白可有25个氨基酸的差异。
含ATP的G-肌动蛋白单体可聚合为含ADP的呈纤维状的F-肌动蛋白,它们可由Mg 及高浓度的K 或Na 诱导而聚合,聚合后ATP水解为ADP及C-肌动蛋白ADP单体,组成F-肌动蛋白。在骨骼肌的细肌丝(thin filament,由肌动蛋白构成)与粗肌丝(thick filament,由肌球蛋白构成)相互作用而使肌肉收缩(肌球蛋白可以起作肌动蛋白激活的ATP酶的作用)。肌球蛋白也存在于哺乳动物的非肌细胞中(但以非聚合状态存在)。
中间纤维
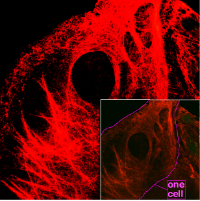
显微镜下的细胞内角蛋白丝
细胞骨架的第三种纤维结构称中等纤维或中间纤维,又称中间丝,为中空的骨状结构,直径介于微管和微丝之间,其化学组成比较复杂,在不同细胞中,成分变化较大。中间纤维使细胞具有张力和抗剪切力。中间纤维有共同的基本结构,即构建成一个中央α螺旋杆状区,两侧则是大小和化学组成不同的端区。端区的多样性决定了中间纤维外形和性质的差异和特异性。
以上这些结构单元并非是一成不变的,而是随细胞的生命活动而呈现高度的动态性,它们均由单体蛋白以较弱的非共价键结合在一起,构成纤维型多聚体,很容易进行组装和去组装,这正是实现其功能所必需的特点。
其他蛋白
不仅如此,细胞骨架还包含有很多结构单元的附属蛋白质,比如:
与微丝相互作用的蛋白
分子马达:动力蛋白,驱动蛋白,肌球蛋白
核化蛋白:Arp2/3复合体,Formin
结合蛋白: 粘着斑蛋白 ( 英语 : vinculin ) , 丝切蛋白 ( 英语 : cofilin ) , Pofilin, 原肌球蛋白 ( 英语 : tropomyosin ) 等等
与微管相互作用的蛋白
动力蛋白:Kinesin,Dynein
广义的细胞骨架还包括核骨架(nucleoskeleton)、核纤层和细胞外基质,形成贯穿于细胞核、细胞质、细胞外的一体化网络结构。
原核细胞骨架
细胞骨架曾经被认为是仅仅是真核细胞的特征,但同源的真核细胞骨架所有主要蛋白在原核细胞已被发现。 虽然进化关系是如此遥远,他们从蛋白质序列比较单独不是显而易见,它们的三维结构和类似的功能,在维持细胞形状和极性的相似度提供了强有力的证据表明,真核的和原核的细胞骨架是真正同源的。 但是,细菌细胞骨架中的某些结构可能还没有被识别。
FtsZ
FtsZ是第一个被发现的原核细胞骨架蛋白,组装在接下来会发生细胞分裂,形成隔板的Z-环上,类似真核生物的肌动蛋白-肌球蛋白收缩环。
参看
细胞
细胞器
微丝
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
关于我们

APP下载




























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}